- 1 joule = 0,24 kalori
- 1 kalori = 4,2 joule
Kalor jenis
Menentukan kalor jenis
Rumus kalor =
Kalor jenis dilambangkan dengan
 . Untuk mencari nilai
. Untuk mencari nilai  rumusnya adalah:
rumusnya adalah:
Contoh 1:
Untuk menaikkan suhu 400 gram timah dari suhu 0 derajat Celcius ke suhu 50 derajat Celcius dibutuhkan kalor sebanyak 30.000 Joule. Berapakah kalor jenis timah tersebut?


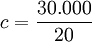

Contoh 2:
Untuk menaikkan suhu 150 gram perak dari suhu 20 derajat celcius ke suhu 40 derajat Celcius dibutuhkan kalor sebanyak 9.000 Joule. Berapakah kalor jenis perak tersebut?

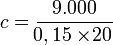

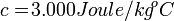
Soal-soal dengan kalor jenis
- Air yang massanya 2 kg suhunya adalah 25°C. Jika kalor jenis air adalah 4.200 Joule/kg°C, berapakah kaloryang dibutuhkan pada suhu 55°C?



Kapasitas kalor
Satuan kapasitas kalor = Joule/°C. Rumus H = m * c.Contoh:
- Kalor jenis alkohol adalah 2,4 J/g°C. Berapakah kapasitas kalor 60 gram alkohol?

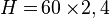

Kalor Uap
Satuan kalor uap = Joule/kg. Rumus = m * U.Contoh 1:
- Tentukan kalor yang dibutuhkan untuk menguapkan air bermassa 40 gram hingga semuanya menjadi uap. Kalor uap air = 2.260.000 J/kg°C.
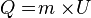
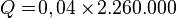
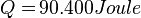
Contoh 2:
- Air bermassa 400 gram suhunya adalah 50°C. Tentukan kalor yang diperlukan untuk menguapkan air tersebut. Kalor uap air = 2,26 MJ/kg, Kalor jenis air = 4.200 Joule/kg°C dan titik didih air = 100°C.
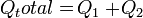
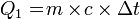

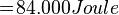
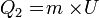
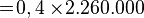
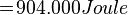


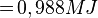
Kalor lebur
Contoh:- Tentuka kalor yang dibutuhkan untuk meleburkan 7 kg es dari suhu -70°C hingga menjadi air bersuhu 10°C. Kalor jenis es = 2.090 Joule/kg°C, Kalor jenis air = 4.200 Joule/kg°C, Kalor lebur es/air = 334.000 J/kg.
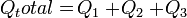
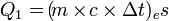


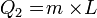
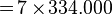

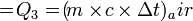

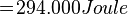



Asas Black
Asas Black dapat diartikan sebagai kalor yang diterima sama dengan kalor yang dilepaskan. Dengan kata lain, kalor yang diterima berarti zat tersebut suhunya rendah dan kalor yang dilepaskan berarti zat tersebut suhunya tinggi.Rumus Asas Black:
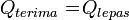
Contoh:
- Alkohol yang massanya 50 gram dan suhunya adalah 66,3°C dimasukkan ke dalam air yang massanya adalah 75 gram dan suhunya adalah 21,9°C. Kalor jenis alkohol = 2,4 J/g°C dan kalor jenis air = 4,2 J/g°C. Berapakah suhu akhir campuran itu?
Q_terima = Q_lepas
m * c * Δt terima = m * c * Δt lepas
50 * 2,4 * (66,3 - t_A) = 75 * 4,2 * (t_A - 21,9)
120 * (66,3 - t_A) = 315 * (t_A - 21,9)
7.956 - 120t_A = 315t_A - 6.898,5
7.956 + 6.898,5 = 315t_A + 120t_A
14.854,5 = 435t_A
t_A = 34,15°C

Tidak ada komentar:
Posting Komentar